
 王泽峰 发布于:2023年10月27日 13:46
王泽峰 发布于:2023年10月27日 13:46
中国科学院上海营养与健康研究所研究员,曾任美国北卡罗来纳大学教堂山分校副教授,中国科学院马普计算生物所所长、研究员。长期从事RNA生物学研究,美国Enzerna Biosci公司、上海环码生物医药有限公司创始人。
近年来,随着小核酸药物的成功商业化,以及mRNA疫苗在新冠疫情中的重要作用,核酸药物成了创新药研发中备受资本青睐的热点。
最早进入RNA药物商业化研发的是反义核酸技术,该技术始于20世纪80年代末。其原理非常简明直接,是利用反义核酸(DNA或RNA)和靶点基因结合,特异性地抑制基因表达或降解有毒性的RNA分子,从而进行疾病治疗。早期的代表性公司有ISIS(2015年更名为Ionis)、Oligogen(后更名为Gilead,即吉利德科学),以及后来停止运营的Hybridon和Genta等。这些公司都是在1990年前成立的,共同思路是用反义核酸来特异性诱导RNA降解或抑制mRNA翻译,从而进行抗病毒或对罕见病和癌症的治疗。
因为反义核酸技术的固有问题,早期的数据并不很可靠,所以吉利德科学公司很快将管线卖出,退出了核酸药物领域。其余的几家公司在经历了几次临床试验和商业授权后,大多因资金和数据不佳停止了运营,只有Ionis公司生存了下来,并在1998年迎来了第一款获得美国食品药品监督管理局(FDA)批准上市的反义核酸药物Fomivirsen。Fomivirsen是一个化学合成的21nt的硫代磷酸寡核苷酸,治疗免疫力低下人群(如艾滋病患者)中的巨细胞病毒(CMV)感染,之后授权给诺华(Novartis)公司,但在2006年退出市场。
近期引起较多关注的是针对脊髓性肌萎缩症的Spinraza(Nusinersen),其通过反义核酸特异性地调控SMN2基因的剪接来提高活性。Spinraza在2021年进入中国,以“70万元1针”的高价受到了广泛关注,而价格也成为其进入医保的重要障碍。
小核酸药物(RNA干扰药物)的起伏
早期反义核酸技术是利用单链RNA来抑制基因表达,其生物活性较低且不稳定。1998年,科学家发现双链RNA介导的RNA干扰(RNAi)可以比反义核酸更高效地识别mRNA并造成其降解,这项发现给核酸药物领域带来了前所未见的热度。接下来,这项技术的发展历程完美地重现了Gartner技术成熟度曲线。也就是说,一个新兴技术从发现到成熟通常会经历以下几个阶段:创新的驱动期(innovation trigger)、期望膨胀的峰值期(peak of inflated expectation)、泡沫破灭的峡谷期(trough of disillusionment)、稳步上升的光明期(slop of enlightenment)和稳定产出的高原期(plateau of productivity)。
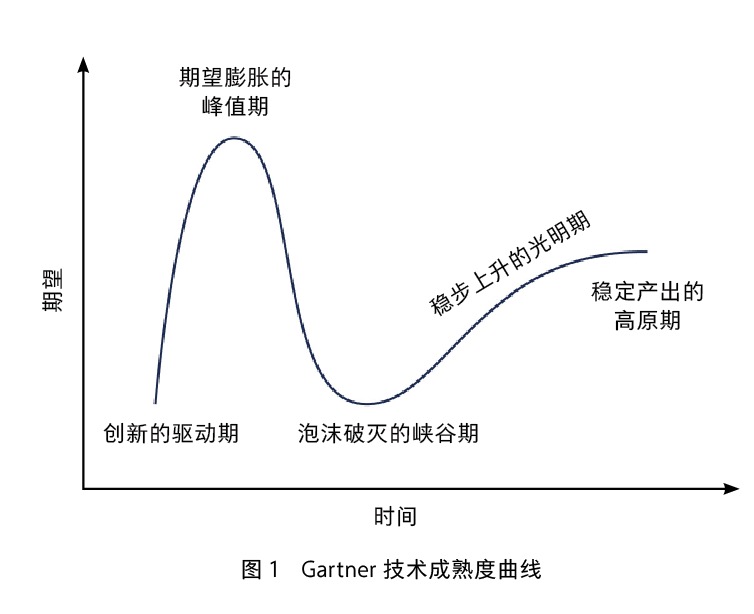
因为人工设计的双链小干扰RNA(siRNA)在理论上可以靶向几乎所有的靶基因,从而实现对各种疾病的治疗,所以整个生物医药领域都意识到这是一个革命性的创新技术。自2002年起,有多家专注于RNAi的新生物技术公司成立,比较有代表性的包括Alnylam和Sirna等,在成立后就吸引了大量投资,并于2006年前后在美国纳斯达克上市,还与多个跨国药企达成管线合作。2006年,RNA干扰获得诺贝尔生理学或医学奖,把这项技术的热度推上了顶峰。这一时期,大量的新公司成立,代表性公司包括美国的Dicerna Pharmaceuticals,以及中国的广州锐博、苏州瑞博、圣诺医药等。
然而,siRNA的体内递送效率极低是当时面临的主要问题,影响到了小RNA的成药性。在随后几年,多个RNA干扰的临床试验效果并不理想,使RNA干扰领域进入了低谷,跨国药企纷纷退出此领域,而以Sirna为代表的早期专注RNA干扰的公司被Merck收购后也不再运营。当时,在美国坚守这个领域的主要公司只剩下Alnylam,但也受到递送效率问题的困扰。
在RNA干扰的低谷期中,大量的研发工作集中于核酸药物的递送上,包括脂质体纳米颗粒(LNP)等一系列技术开始积累,终于为核酸递送难题带来突破。2018年,RNA干扰治疗迎来了新的曙光,FDA批准了Alnylam公司研发的首个基于RNA干扰的药物Onpattro(Patisiran),这是针对遗传性甲状腺素蛋白淀粉样变性的一款小RNA药物。随着新的递送方法在不同器官中的优化和拓展,以及更高特异性和药效的先进RNA干扰负载策略的开发,RNA干扰领域进入了稳步上升的光明期,新的突破性疗法不断涌现。可以预见,它将在接下来的5年走入技术成熟的高原期。
与RNA干扰和反义核酸技术对目标基因的抑制不同,mRNA疗法是将mRNA导入细胞来促进目标基因的表达,从而进行各类疾病的治疗。mRNA疗法的设想其实早在20世纪八九十年代就被提出,并在90年代初期被发现mRNA表达的外源蛋白可以诱导动物产生特异抗体。第一家mRNA药物公司Merix于1997年在美国成立。2000年,从事mRNA疫苗的CureVac公司成立。然而,在接下来的时间里,受mRNA的低稳定性和免疫原性影响,这个领域发展遇到很大的困难。与可以通过化学合成的小核酸不同,mRNA只能通过RNA聚合酶反应来制备,而合成后的mRNA需要进行加帽和加尾修饰才能被翻译,整个生产过程工艺复杂且成本很高。同时,体外合成的mRNA稳定性很差,严重缩短了其有效治疗窗口。为了提高稳定性,需要通过序列设计增加RNA的结构,而增加RNA结构又提高了mRNA的天然免疫原性,这种免疫原性导致的细胞免疫反应会进一步抑制mRNA翻译效率。
国际核酸药物研发对我国的启示
核酸药物作为最重要的新模式药物之一,其研发经过了长期曲折的过程,而且这个过程还在继续。总结这些国际上核酸药物的研发历程,对我国创新药的研制有着借鉴意义。这种借鉴涉及技术、资本和监管等3个方面。
在科研技术层面,核酸药物成功研发需要依靠基础研究的长期积累。从创新性发现开始到最后成药,中间的道路曲折多变。因此,在这个过程中,需要尊重科研本身的规律,针对根本问题瞄准最终目标扎扎实实走下去,而不总是通过捷径来“弯道超车”。例如,mRNA药物中所用的知识是在技术成熟的20~30年前就被发现并逐步积累出来的,在某个时间点看到的“弯道超车”机会,不见得真是捷径而有可能是歧路。同时,核酸药研发涉及分子生物学、生物化学、计算生物学、基础医学等多个方面的突破,是一个非常复杂的系统工程,在其中每人的工作像大拼图的一小块。因此,科学家和工程师还需要有开放的心态和耐心,形成一个开放合作的文化,使技术的积累可以继承下去。例如,在反义核酸药物研发中,尽管前期经历了许多失败,但是也在核酸化学合成和递送技术上有了重要进展和宝贵经验,为之后的小核酸药物打下了基础。小核酸药物的瓶颈期也积累了关于递送的大量经验,这也是mRNA药物成功的重要一环。
在资本层面,小核酸药物和mRNA药物的几番冷热也给我们带来了启发。目前,专注创新药领域的资本很多,但这些资本方习惯上还是希望对标国际公司的技术路线。作为从业人员,笔者其实希望中国的资本方可以发挥一下想象力和心理定力,敢于为原始创新下注和买单,而不只是根据管线进展来算收益率或简单追逐国际热点。记得在2021年,大量资本进入核酸药物领域,一些其实并没有很好创新性的项目也由于商业化路径明显而受到追捧。然而,这种“繁荣”是无法持久的,一年后进入了资本寒冬,许多有很好潜力的项目也变得无人问津。可惜的是,核酸药物经历过的冷热循环,目前正在AI药物上重演。其实,真正的技术创新通常是以大致稳定的节奏涌现而不会忽然到来,所以资本的忽冷忽热其实是不利于创新的。很多时候,专业的资本方需要提高风险的承受力,也需要做好出资人的教育工作,越是创新技术就越有失败的风险,为人类健康事业的科技创新买单总不是一件坏事,至少是帮助富人树立了正确的“炫富观”。
需要指出的是,药物研发是造福全人类的事业,也是使世界变得更美好的事业。在这个过程中需要全社会的努力与合作,更需要跨国界的合作与知识共享,这充分体现了“人类命运共同体”的精粹。中国人在利用国外技术的同时,也要向国际上的知识积累奉献自己的力量。作为一个步入老龄化的人口大国,中国应该也必须在这个领域作出贡献。