安之音 徐颖洁 发布于:2023年10月27日 14:06
安之音 徐颖洁 发布于:2023年10月27日 14:06
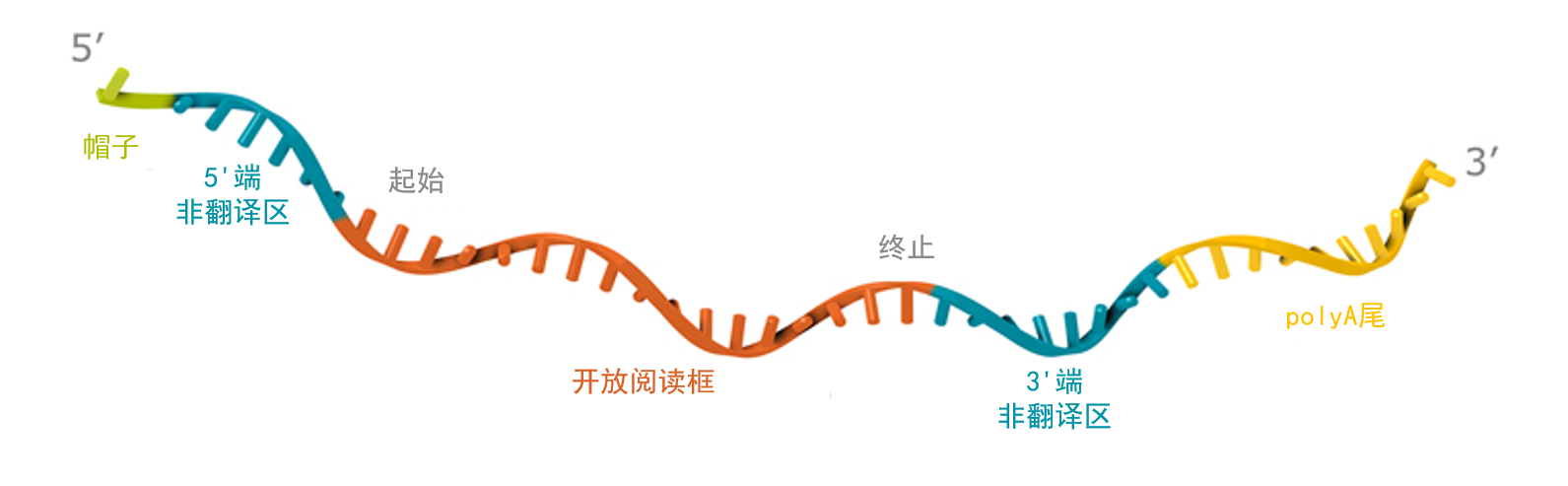
#2023年诺贝尔生理学或医学奖 北京时间10月2日,“2023年诺贝尔生理学或医学奖”获奖名单揭晓。瑞典斯德哥尔摩卡罗林斯卡学院(Karolinska Institute)的诺贝尔大会宣布,将该奖项授予美国科学家卡塔林·卡里科(Katalin Karikó)和德鲁·魏斯曼(Drew Weissman),因为他们发现了核苷酸基修饰,从而开发出有效的抗COVID-19 mRNA疫苗。 Katalin Karikó和Drew Weissman获得“2023年诺贝尔生理学或医学奖”。 图片来源:诺奖官网 文|安之音,上海交通大学医学院研究生。 徐颖洁,上海交通大学医学院生物化学与分子细胞生物学系mRNA治疗应用课题组组长,博士生导师。 信使RNA(mRNA)疫苗是通过体外转录技术合成编码抗原的mRNA,借助递送系统运送到特定的组织细胞内,由宿主细胞自身的翻译系统翻译出目标蛋白,并激发免疫反应的一种疫苗。新冠mRNA疫苗的横空出世,充分体现了其靶点灵活性高、安全有效、生产快速、研发周期短等优势。mRNA不仅适用于感染性疾病的预防和治疗,在肿瘤免疫治疗、罕见遗传病治疗、抗衰老等方向也有无限的潜力,已然成为生物医药产业最前沿的发展方向。 与天然的真核生物mRNA相似,体外转录mRNA包含5'端帽子、5'端及3'端非翻译区(UTR)、开放阅读框(ORF)和多聚腺苷酸(polyA)尾。 针对上述mRNA分子的各部件,5'端帽子类似物的开发、UTR序列库的筛选、ORF的密码子优化、PolyA尾长度和序列的设计优化,都有助于提高mRNA的稳定性和翻译效率。化学修饰核苷的引入解决了体外转录mRNA成药的障碍之一,不仅降低了免疫原性,还通过降低双链RNA依赖性蛋白激酶的激活增加了mRNA的表达量。此外,采用包括高效液相色谱法在内的mRNA纯化工艺,能有效去除体外转录mRNA生产过程中的DNA模板和副产物(如双链RNA),从而进一步减少mRNA药物进入体内的不良反应。 mRNA疫苗的应用离不开核酸药物递送系统的发展。除了直接递送裸mRNA分子外,还可以借助脂质、多聚物、多肽、蛋白及病毒样颗粒等载体递送mRNA。递送平台的包裹帮助mRNA分子克服多种细胞内外的障碍,包括被生理体液中的核酸酶降解、被单核吞噬系统拦截、全身给药后被肾小球滤过清除,以及提高mRNA在到达靶组织并被内吞到细胞质后进行翻译的能力。目前,最常用的mRNA药物递送方式是脂质纳米颗粒(LNP)。通过调节脂质组成和复合物的静电荷,可以将静脉输入的mRNA脂质复合物(mRNA-LPX)递送至树突状细胞,实现癌症mRNA疫苗的靶向递送。基于核酸递送方式的改进,mRNA疫苗可以实现局部递送,包括肌肉注射、鼻内给药、皮下注射和瘤内注射等。通过系统性给药,实现组织和器官特异性mRNA递送的手段包括选择性器官靶向(SORT)、用于细胞递送的选择性内源性包壳(SEND),以及抗体偶联LNPs等。mRNA递送系统的优化对于mRNA药物实现更广阔的应用至关重要。 应对感染性疾病的mRNA疫苗 应对感染性疾病的mRNA疫苗主要为预防性疫苗,编码病原体特异的结构蛋白。根据编码的结构蛋白的不同,mRNA疫苗可以用于预防多种病毒,如严重急性呼吸道冠状病毒Ⅱ型(SARS-CoV-2)、人免疫缺陷病毒(HIV)、流感病毒、寨卡病毒(ZIKV)、埃博拉病毒(EBOV)、狂犬病毒(RABV)、疱疹病毒(HSV)、呼吸道合胞病毒(RSV)、巨细胞病毒(CMV),以及致病性细菌和寄生虫等的感染。 2019年,新冠疫情的暴发极大地促进了mRNA疫苗的发展。mRNA疫苗在设计和生产上的优势决定了其可以快速应对新发传染病。在新冠疫苗的研发中,生物制药公司辉瑞和BioNTech研发的疫苗BNT162b2和Moderna公司研发的疫苗mRNA-1273在临床试验中的有效性达到95%以上,率先获得美国食品药品监督管理局(FDA)的紧急使用授权,在全球范围内大范围接种。在Omicron突变株流行之后,Moderna公司研发的二价mRNA疫苗(野生型+Omicron BA.4/BA.5)也获得了使用授权。截至2023年3月30日,进入临床试验的新冠mRNA疫苗已经多达43种。 在多种传染性病原体中,HIV长期受到关注,但是,目前还没有已经通过临床试验的HIV病毒疫苗。关于HIV的mRNA疫苗研究,第一个尝试是将编码HIV gag蛋白的mRNA转入树突状细胞,诱导产生体外初始免疫反应。美国马萨诸塞大学教授艾伦·雅各布森(Allan Jacobson)等设计了编码Gag、Rev、Vpr和Nef蛋白的mRNA疫苗,用树突状细胞递送。在临床试验中,虽然接种者产生了更多抗HIV的CD8+ T细胞,但是并没有观察到明显的抗病毒效果。国际艾滋病疫苗行动组织(IAVI)赞助研发的重组亚单位疫苗IAVI G001用eOD-GT8 60mer作为抗原,接种后产生大量的抗HIV IgG。在此研究基础上,Moderna公司与其合作,研发了编码eOD-GT8抗原的mRNA疫苗(mRNA-1644)并开始了I期临床试验。 流感病毒分为很多亚种,其流行不仅会造成严重的公共卫生问题,还会影响畜牧业的发展。用编码流感病毒HA抗原的未修饰mRNA免疫小鼠和猪后,可以降低其患流感的概率。目前,预防H10N8和H7N9的mRNA疫苗已经进入临床试验。 寨卡病毒感染可以引起新生儿的先天性畸形,临床前研究表明,编码prM-E蛋白的化学修饰的mNRA疫苗可以有效预防小鼠和灵长类动物由寨卡病毒引起的先天性疾病。Moderna公司开展Ⅰ期临床试验,发现编码prM-E的mRNA疫苗(mRNA-1325)在可以诱导人体产生抗寨卡病毒的中和抗体,试验结果支持mRNA-1325的进一步研发。 埃博拉病毒可以引起严重的出血热症状,死亡率极高。美国得克萨斯大学医学分院米歇尔·迈耶(Michelle Meyer)等设计了两种mRNA疫苗可以保护豚鼠免受致命的埃博拉病毒感染,免疫后的豚鼠在埃博拉病毒暴露之后没有出现相应的临床症状。 预防狂犬病毒的mRNA疫苗(CV7201)由CureVac公司的RNActive平台研发,在Ⅰ期临床试验中可以诱导接种者产生抗狂犬病毒的中和抗体。 疱疹病毒可以造成生殖器疱疹和宫颈癌,编码gD2、gC2和gE2蛋白的三价mRNA疫苗可以预防疱疹病毒感染造成的生殖器疱疹。 自复制mRNA(saRNA)对治疗慢性感染性疾病比传统mRNA疫苗更有优势。除了常规的递送方式外,saRNA疫苗还可以通过病毒复制子颗粒的形式进行体内递送。目前,流感和新冠感染的SaRNA疫苗已经进入临床研究。 基于mRNA疫苗的肿瘤免疫治疗 肿瘤免疫治疗旨在通过调节免疫抑制的肿瘤微环境激活抗肿瘤免疫,增加癌症患者的生存期。抗肿瘤mRNA疫苗主要编码肿瘤相关抗原(TAA)和肿瘤特异性抗原(TSA),促进免疫系统对肿瘤细胞的识别和攻击。除了mRNA疫苗之外,编码细胞因子和免疫检查点抗体的mRNA药物也可以用于肿瘤免疫治疗。 在抗肿瘤mRNA疫苗研发的道路上,一个关键的阻碍是抗原选择的困难性。相较于传统疫苗,mRNA疫苗可以同时递送多种TAA抗原,增加免疫有效性,并且编码的全长肿瘤抗原可以使抗原呈递细胞同时激活人白细胞抗原Ⅰ类分子和Ⅱ类分子,激活更强的T细胞免疫。目前,已经有超过20种治疗肿瘤的mRNA疫苗进入临床试验。 由于黑色素瘤具有较强的免疫原性和靶向性,对于黑色素瘤的mRNA免疫治疗的研究相对于其他肿瘤疾病进展更快。编码4种黑色素瘤抗原(NY-ESO-1、MAGE-C3、tyrosinase、gp100)的由脂质复合物递送的mRNA疫苗BNT111可以诱导患者产生特异性的T细胞反应,其与抗PD-1抗体药物联用的治疗方案已经进入Ⅳ期临床试验。将电转编码黑色素瘤相关抗原融合蛋白的树突状细胞静脉输入黑色素瘤患者体内,可以控制疾病的进展。编码6种人非小细胞肺癌相关抗原的mRNA疫苗CV9201和CV9202,在临床试验中展现出良好的治疗效果。编码4种前列腺癌抗原的mRNA疫苗CV9103和改良后的CV9104增加了去势抵抗性前列腺癌患者的预期生存时间。除了实体瘤外,mRNA疫苗在急性髓细胞白血病的治疗中也展现了很好的效果。 肿瘤特异性抗原(TSA),即新抗原(neoantigen)是具有更强肿瘤特异性的抗原表位,因此经常作为mRNA疫苗设计的靶点。由于肿瘤细胞的新抗原具有很强的个体差异性,一个肿瘤患者的不同肿瘤细胞的特征也存在差异,肿瘤学和免疫学专家乌乌尔·沙欣(Ugur Sahin)团队于2012年提出了靶向肿瘤突变组的个性化疫苗疗法。多种计算机算法可以加速新抗原的发现,帮助个性化疫苗的设计。目前,这种疗法在黑色素瘤、胶质母细胞瘤和一些其他的实体瘤中都展现了良好的治疗效果。Moderna和Merck公司合作研发的疫苗mRNA-5671编码Kras新抗原,单独或与Merck公司的PD-1特异性抗体帕博利珠单抗(pembrolizumab)联合用于胰腺癌的治疗,该药物目前在临床试验阶段。Moderna公司的个性化肿瘤疫苗由34个新抗原基因组成,与帕博利珠单抗联用不仅可以保证药物安全性和耐受性,也提高了人乳头瘤病毒(HPV)阴性头颈鳞癌的总缓解率和完全缓解率。BioNTech公司与Genentech公司正在临床试验中评估疫苗RO7198457与PD-L1抗体联用在转移性实体瘤中的作用,其中在黑色素瘤中的治疗响应率达到30%。在最近报道的胰腺导管腺癌(PDAC)的肿瘤新抗原mRNA疫苗与抗PD-L1免疫疗法及化疗方案联用的临床试验中,有一半的患者接种疫苗后,在血液中检测到识别与mRNA编码肽相对应的特定新抗原的T细胞。这些免疫应答者在手术后18个月的中位随访时间没有癌症复发,而无反应者的中位随访时间为13.4个月,结果令人鼓舞。此外,病毒感染引起的肿瘤也可以用mRNA疫苗进行预防和治疗,如抗HPV、EBV及HBV疫苗。报道显示,局部放射治疗与疫苗E7 RNA-PLX联合治疗可以提高对HPV+肿瘤模型治疗的有效性。 mRNA疫苗在感染性疾病和肿瘤的预防和治疗中都展现了良好的临床结果和应用前景,随着mRNA体外合成技术、递送平台及制剂工艺的优化,我们期待mRNA疫苗在更广阔的生物医药领域发挥作用。